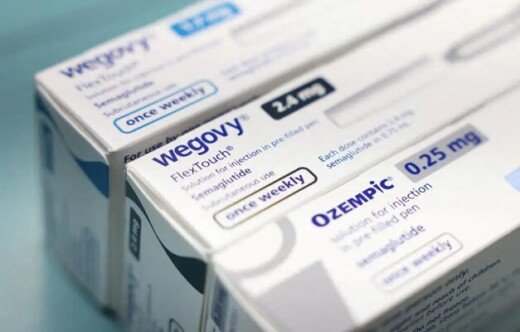
A Agência Nacional de Vigilância Sanitária (Anvisa) determinou que, desde 23 de junho de 2025, todas as receitas médicas para medicamentos à base de agonistas de GLP-1 — como semaglutida (Ozempic, Wegovy), tirzepatida (Mounjaro) e similares — devem ser emitidas em duas vias e uma delas obrigatoriamente retida pelas farmácias e drogarias em todo o país. A medida, anunciada em abril, tem validade de 90 dias a partir da emissão da receita e exige que cada prescrição permita no máximo 30 dias de tratamento.
Segundo a Anvisa, a decisão foi tomada após o crescimento expressivo do uso desses medicamentos para fins estéticos, muitas vezes sem indicação médica, o que contribuiu para o aumento dos relatos de eventos adversos. Entre as reações mais comuns estão náuseas, vômitos, hipoglicemia e, em casos mais graves, pancreatite. De acordo com a agência, 32% dos relatos de reações adversas à semaglutida no Brasil foram associados ao uso off-label (ou seja, fora das indicações aprovadas), percentual três vezes maior do que a média global, que é de cerca de 10%.
Relatório da Diretoria Colegiada da Anvisa revelou que 45% dos usuários desses medicamentos não possuem prescrição médica e, entre eles, 73% afirmaram não ter recebido qualquer orientação de um profissional de saúde. Ainda segundo o levantamento, 56% das pessoas utilizam as canetas com objetivo de emagrecimento e 37% delas não apresentam sobrepeso ou obesidade, demonstrando o desvio de finalidade no consumo desses produtos. Outro dado apontado pela agência indica que 54% dos pacientes com indicação clínica para o tratamento relataram dificuldades para encontrar o medicamento disponível nas farmácias.
O aumento das importações de insumos para produção dessas canetas também chamou a atenção da Anvisa e de entidades do setor farmacêutico. Entre 2023 e 2025, o Brasil importou 17,8 kg de semaglutida — quantidade suficiente para fabricar aproximadamente 4 milhões de canetas de Ozempic — e 10 milhões de doses de tirzepatida, substância ainda não aprovada para comercialização no país, o que equivale a quase 2 milhões de canetas do produto.
Apesar do novo controle, o uso off-label segue permitido, desde que a decisão seja tomada pelo médico responsável, com avaliação dos riscos e benefícios. A prática é respaldada por entidades médicas como a Associação Brasileira para o Estudo da Obesidade e Síndrome Metabólica (Abeso), a Sociedade Brasileira de Diabetes (SBD) e a Sociedade Brasileira de Endocrinologia e Metabologia (Sbem), que alertaram em carta aberta para os riscos da banalização do uso desses medicamentos sem acompanhamento adequado. O presidente da Abeso, Fábio Trujilho, ressaltou que a facilidade de acesso pode expor idosos e pessoas com contraindicações ao risco de automedicação e complicações, defendendo a necessidade de acompanhamento clínico rigoroso.
Farmacêuticas responsáveis pela produção das canetas emagrecedoras também se manifestaram. A Novo Nordisk, fabricante do Ozempic e Wegovy, afirmou que a retenção de receitas é relevante, mas não resolve todos os problemas relacionados à automedicação, uso off-label ou falsificação. A empresa alertou ainda para o risco de estigmatização dos pacientes que dependem dos medicamentos sob orientação médica. Já a Eli Lilly, produtora do Mounjaro, declarou apoio ao controle, mas ponderou que a retenção de receitas, isoladamente, não é suficiente para combater a manipulação irregular, sobretudo em larga escala.
Para os consumidores, o novo procedimento exige apresentação da receita em duas vias, retenção de uma delas pela farmácia, registro no Sistema Nacional de Gerenciamento de Produtos Controlados (SNGPC) e validade máxima de 90 dias. Medicamentos à base de semaglutida, tirzepatida e similares passam a ter o mesmo grau de controle que os antibióticos.
O objetivo da medida é reduzir o acesso indiscriminado, garantir o acompanhamento médico contínuo dos pacientes e aumentar a rastreabilidade das vendas. A Anvisa informou que o impacto do novo procedimento será monitorado nos próximos meses, tanto por meio das notificações de eventos adversos quanto pela análise da disponibilidade dos medicamentos no setor privado e no Sistema Único de Saúde (SUS).